L'EPSP Synthase
Fonction
Inhibition par le glyphosate
L'EPSPS, une enzymme impliquée dans la biosynthèse des acides aminés aromatiques chez les plantes et les bactéries
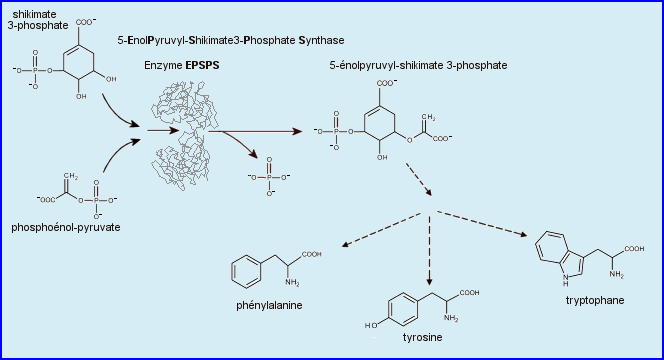
L'enzyme 5-EnolylPyruvyl-Shikimate 3-Phosphate Synthase (EPSPS) catalyse une réaction (voir ci-dessous) indispensable pour alimenter les voies de biosynthèse des acides aminés aromatiques Phe, Tyr et Trp, chez les plantes et les bactéries. Elle utilise 2 substrats le shikimate 3-P (S3P) et le phosphoénol-pyruvate(PEP).
On distingue des PESPS de classe I chez les plantes et certaines bactéries comme Escherichia coli et des PESPS de classe II chez d'autres bactéries comme Agrobactérium tumefaciens. Ainsi, celle de E. coli présente plus de similitude avec celle de Arabidopsis thaliana qu'avec celle de Agrobacterium.
Rq/ Chez les plantes, l'enzyme est transférée dans les chloroplastes où a lieu la réaction.
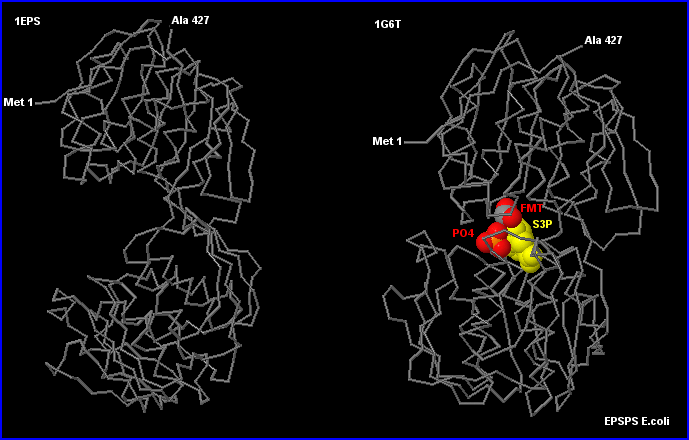
L'enzyme est constituée par 2 domaines qui ménagent entre-eux une cavité où se situe le site actif dans lequel FMT et PO43- doivent occuper la place du deuxième substrat PEP. Lors de la réaction, il doit y avoir rapprochement des 2 domaines, l'enzyme passant d'une configuration ouverte (à G) à une structure plus compacte, fermée (à D). Il semble que c'est la fixation de S3P (premier substrat) dans le site actif qui induit le changement de configuration à l'origine de la mise en place d'un environnement chargé (au voisinage du substrat en place) très favorable au positionnement du deuxième substrat PEP. Une fois les 2 substrats en place dans le site actif, le transfert du groupement énolpyruvyl de PEP sur SMT peut avoir lieu.
L'EPSPS (classe I) inhibée par le glyphosate
In situ, la présence du glyphosate peut inhiber la réaction catalysée par une EPSPS de classe I et ainsi bloquer la synthèse des acides aminés aromatiques, ce qui est incompatible avec la vie de la plante et de la bactérie.
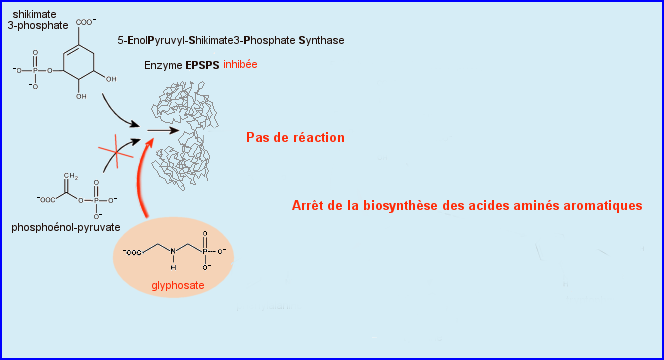
Le modèle moléculaire ci-dessous montre, dans le site actif de l'enzyme, le premier substrat (S3P) et le glyphosate (GPJ) qui occupe la place du deuxième substrat PEP. Quand l'enzyme est en présence de PEP et de glyphosate, il y a compétition entre les deux ligands potentiels pour occuper une partie bien définie du site actif. Si il y a suffisamment de glyphosate par rapport au substrat naturel, il y a formation de complexes E-S3P-glyphosate et la réaction ne se produit pas (inhibition compétitive).
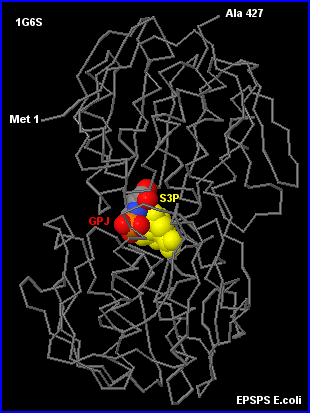
GPJ = glyphosate = inhibiteur