
La chaîne respiratoire "classique" et les phosphorylations oxydatives
La chaîne respiratoire "classique" intervient dans les mitochondries animales et végétales. Elle oxyde les petites molécules NADH et FADH2 , fournies par le catabolisme cellulaire, avec la participation de O2 qui est alors réduit en H2O. L'énergie de leur oxydation est utilisée pour la synthèse d'ATP à partir de l'ADP (phosphorylation oxydative).
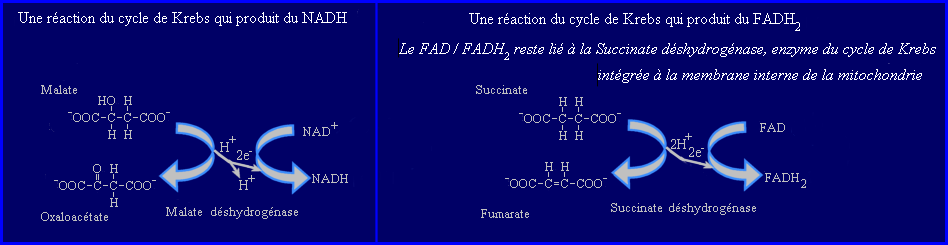
NADH et FADH2 détiennent une paire d'électrons à haut potentiel énergétique. C'est au cours des étapes (glycolyse, cycle de Krebs surtout ) qui précèdent l'intervention de la chaîne mitochondriale que certaines réactions de déshydrogénation impliquées dans la dégradation des substrats respiratoires transfèrent 2e-+ H+ d'un métabolite intermédiaire au NAD+ ou 2e- + 2H+ d'un autre métabolite intermédiaire au FAD. Chaque fois qu'une molécule de NADH ou de FADH2 est formée, il y a sauvegarde d'une partie de l'énergie chimique initialement présente dans le substrat respiratoire, sous la forme d'une paire d'électrons "riches" en énergie enlevés à un métabolite intermédiaire par le coenzyme.
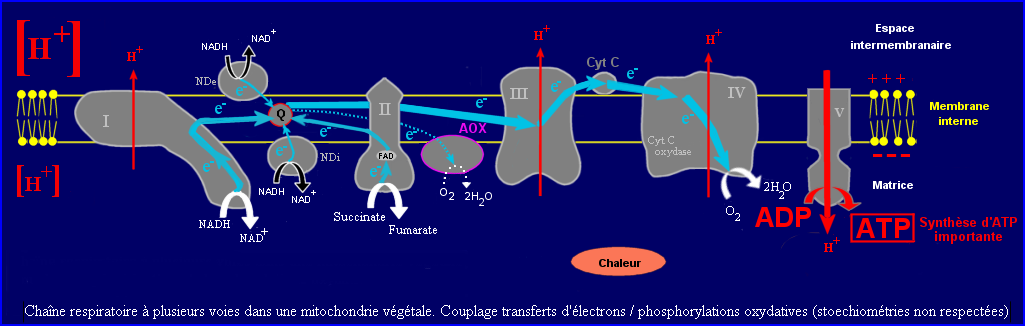
- La chaîne respiratoire mitochondriale transfère les électrons du NADH (et du FADH2 ) à O2 non pas directement, mais par étapes avec l'intervention de transporteurs intermédiaires situés dans la membrane interne.
Pour l'oxydation du NADH, 3 gros complexes enzymatiques et 2 plus petits transporteurs capables de se lier transitoirement aux complexes sont impliqués. Le processus débute par la déshydrogénation du NADH qui perd 2e- + H+. Les électrons captés par le complexe I (NADH-Qoxydoréductase) sont transférés au Coenzyme Q (ubiquinone) molécule liposoluble qui diffuse facilement dans la bicouche phospholipidique. Sa forme réduite (ubiquinol) cède à son tour la paire d'électrons au complexe III (Q-cytochrome C oxydoréductase) qui les transfère au Cytochrome C (petite protéine hydrosoluble) à raison d'un seul électron par molécule réduite.
Chaque molécule de Cyt C red livre un électron au complexe IV (Cytochrome C oxydase) qui catalyse la réduction de l'oxygène moléculaire. Le complexe IV fixe donc 4e- et 4H+ sur une molécule de O2 pour former 2 H2O. Chaque e- est fourni par une molécule de Cyt C différente, les H+ sont prélevés dans la matrice.
Le pouvoir réducteur du FADH2 est plus faible que celui du NADH, les électrons qu'il cède sont transférés au coenzyme Q par l'intermédiaie du complexe II (succinate déshydrogénase = succinate Q-réductase).
rq/ Les complexes de la chaîne respiratoire sont constitués par plusieurs sous-unités protéiques associées. Ils comprennent des groupements prosthétiques, non protéiques
(centres fer-soufre, hèmes...) spécialisés dans les transferts d'électrons. Il y a des transports d'électrons au sein des complexes.
- L'intervention des réactions successives d'oxydoréduction de la chaîne respiratoire permet de libérer l'énergie initialement disponible dans les petites molécules réduites NADH et FADH2 par étapes et d'en récupérer une partie pour la phosphorylation oxydative. Le concept de potentiel redox peut permettre de mieux appréhender les aspects énergétiques du fonctionnement de la chaîne respiratoire. Chaque couple redox peut être caractérisé par son potentiel redox standard E'0, ici à pH =7 (et non pH =0 comme en chimie). E'0 traduit l'affinité d'un couple pour les électrons. Un E'0 fortement négatif indique un couple dont la forme réduite donne facilement des électrons, c'est le cas des couples NAD+ / NADH ( E'0 =-0,32 V) et FAD / FADH2 (-0,22V) .Un E'0 fortement positif indique un couple dont la forme oxydée a tendance à accepter des électrons, c'est le cas du couple O2 / H2O ( E'0 = +0,82V). Il peut y avoir tranfert spontané d'électron (s) d'un couple A à un autre B si E'0B>E'0A et la quantité d'énergie libérée par la réaction dépend de l'écart entre E'0B et E'0A. Si l'écart est suffisant, l'énergie libérée par la réaction thermodynamiquement favorable (exergonique) peut être utilisée pour permettre à une réaction non termodynamiquement favorable (endergonique) de se dérouler à condition qu'il existe un facteur de couplage entre les deux.
Les transports d'électrons de la chaîne respiratoire se font dans le sens des E'0 croissants, ils sont spontanés. Ceux qui mettent en jeu les complexes I, III, IV sont suffisamment exergoniques pour être couplés à un pompage de protons (processus endergonique) au travers de la membrane interne de la mitochondrie. Le passage des H+ de la matrice à l'espace intermembranaire génère un gradient de pH ( pH matrice> pH espace inter. = pH cytosol) et un gradient de voltage ou DDP transmembranaire ( matrice à un potentiel négatif par rapport à espace inter.). L'énergie du flux d'électrons est utilisée pour la mise en place d'un gradient électrochimique de protons qui comprend 2 composantes DpH et DV. Il génère une force proton-motrice qui tend à ramener des H+ vers la matrice. La composante électrique est plus efficace que le gradient de concentration de H+ pour attirer les protons vers la matrice. Les complexes I, III, IV pourraient pomper respectivement 4, 4 et 2 H+ par paire d'électrons transférés.
Sous l'effet de la force proton-motrice, des
H+ peuvent s'écouler de l'espace intermembranaire vers la matrice par l'intermédiaire de l'ATP synthase, complexe enzymatique qui constitue une voie hydrophile à travers la bicouche phospholipidique. Le mouvement des H+ est un processus exergonique, il est couplé avec la phosphorylation de l'ADP en ATP, réaction endergonique, catalysée par la partie de l'ATP synthase située du côté matrice. La synthèse d'une molécule d'ATP nécessiterait un flux d'environ 3H+. Ainsi, on peut considérer que 3 molécules environ d'ADP pourraient être phosphorylées quand 1 molécule de NADH est oxydée par la chaîne respiratoire, 2 seulement quand c'est FADH2. Les ions CN- bloquent le transfert des électrons au viveau de la cytochrome C oxydase.
La chaîne respiratoire "classique" convertit une bonne partie de l'énergie de l'oxydation des petites molécules NADH et FADH2 en énergie retrouvée dans la liaison phosphate créée lors de la synthèse de l'ATP à partir de l'ADP. Le reste est dissipé sous forme de chaleur. L'ATP est ensuite exporté (navette) vers le cytosol où il est hydrolysé pour permettre les réactions métaboliques endergoniques et les processus cellulaires énergie-dépendants (transports actifs, cyclose....).
Différentes possibilités pour l'entrée dans la chaîne respiratoire des électrons cédés par le NADH
La membrane interne des mitochondries végétales comprend une NADH déshydrogénase externe (NDe) et une NADH déshydrogénase interne (NDi) qui peuvent court-circuiter l'intervention du complexe I. L'enzyme NDi oxyde les molécules de NADH produites par le cycle de Krebs quand leur concentration est très élevée dans la matrice, alors que l'enzyme NDe oxyde directement le NADH produit par la glycolyse dans le cytosol (il passe facilement dans l'espace intermembranire).
Le flux d'électrons de la chaîne respiratoire peut être dérivé vers l'oxydase finale AOX : la respiration alternative
L'alternative oxydase (AOX) est une enzyme intégrée à la membrane interne des mitochondries végétales, du côté matrice. Elle couple directement l'oxydation des molécules d'ubiquinol (coenzyme Q red) à la réduction de O2 en H2O mais elle ne constitue pas un site de pompage de protons. Elle a une bien plus grande affinité pour O2 que la CytC oxydase. L'AOX est l'oxydase finale d'une voie alternative de transfert d'électrons qui court-circuite 2 sites de pompage de H+ (voire les trois si les enzymes NDe et / ou NDi interviennent) et ne produit que peu (voire pas) d'ATP. Ainsi, lorsque les électrons sont dérivés vers l'AOX, une grande partie de l'énergie (voire toute) libérée au cours de l'oxydation des molécules de NADH et de FADH2 est dissipée sous forme de chaleur. L'AOX n'est pas inhibée par les ions CN-.
Dans la mitochondrie végétale, la répartition des électrons entre la chaîne de la cytC oxydase et celle de l'AOX dépend des besoins énergétiques de la plante et des conditions environnementales. La voie alternative en général peu ou pas utilisée, peut être privilégiée dans les mitochondries d'une part pour limiter la formation d'espèces activées de l'oxygène (ion superoxyde ...) en cas de stress biotique ou abiotique et d'autre part lorsque la charge énergétique est élevée (concentration élevée en ATP) pour réguler le catabolisme. La chaleur dissipée est alors insuffisante pour échauffer les organes concernés. Dans le cas de l'appendice de l'Arum, en phase thermogénique, l'AOX est surexprimée et la voie alternative est pratiquement la seule à intervenir.
La respiration alternative génère la chaleur qui échauffe l'appendice de l'Arum maculatum pendant la phase thermogénique
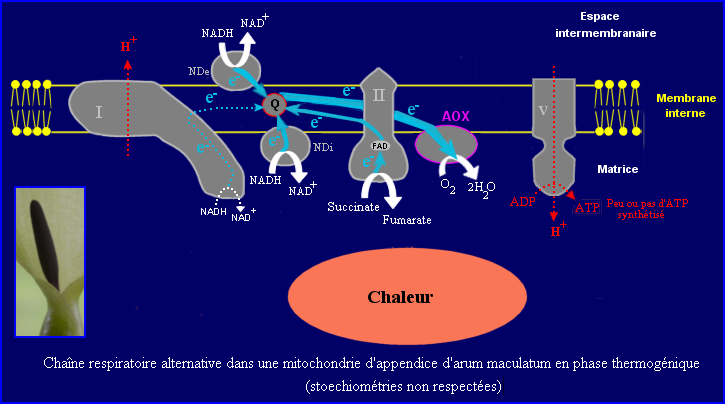
Lorsque la voie de l'AOX fonctionne seule dans les mitochondries de l'appendice de l'Arum maculatum en phase thermogénique, le transfert des électrons fournis par les transporteurs NADH et FADH2 est en grande partie ou totalement découplé de la mise en place du gradient de [H+]. L'oxydation du NADH fait d'ailleurs surtout intervenir les déshydrogénases NDe et NDi (complexe I contourné). Dans ces conditions, le flux de H+ au niveau de l'ATP synthase est peu (ou n'est pas) alimenté, la synthèse d'ATP est donc considérablement ralentie ou nulle, une grande partie (voire toute) l'énergie chimique initialement présente dans les molécules de NADH et FADH2 est convertie en chaleur. Il y a suffisamment de chaleur produite pour permettre une augmentation importante de la température de l'appendice de l'inflorescence de l'Arum maculatum (jusqu'à +20°C / t° ambiante) pendant la phase thermogénique.