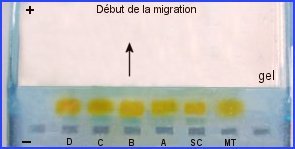
Obtention de profils ADN monolocus
Protocole expérimental
TP Term S
Principe de l'expérimentation
- Amplifier (PCR) à partir d'échantillons d'ADN fournis, un marqueur présentant un polymorphisme de longueur.
- Déterminer le génotype (pour le marqueur) de chaque échantillon en séparant les amplicons par électrophorèse en gel et en se référant à un marqueur de taille.
- Comparer les génotypes
Etapes du protocole expérimental
- Préparation des microtubes pour PCR
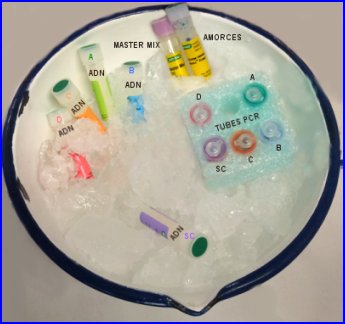
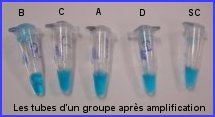
Cinq microtubes contenant chacun un ADN à analyser sont préparés pour la PCR
- tube SC : 20µl ADN scène du crime + 20 µl de solution d'amplification
- tube A : ADN suspect A + 20 µl de solution d'amplification
- tube B : ADN suspect B + 20 µl de solution d'amplification
- tube C : ADN suspect C + 20 µl de solution d'amplification
- tube D : ADN suspect D + 20 µl de solution d'amplification
- Amplification par PCR du marqueur sélectionné
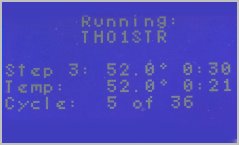
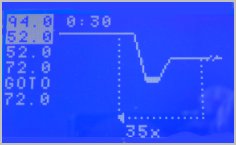
Les microtubes sont placés dans le thermocycleur programmé de façon à enchaîner 35 fois les cycles suivants :
- dénaturation : 94°C pendant 30s
- hybridation des amorces : 52°C pendant 30s
- extension : 72°C pendant 1 min


- Séparation des amplicons par électrophorèse en gel d'agarose
- Préparation des gels
Agarose pour fragments d'ADN courts dans Tampon 1 x TAE
- Dépôts des échantillons
Préparation du marqueur de taille (allèles ladder) qui va servir de référence : tube MT.
Ajout dans chacun des microtubes A, B, C, D, SC contenant les produits de PCR et dans le tube MT, de 10µl de tampon de charge. Il contient du glycérol (pour "lester") et le colorant Orange G qui permet de mieux contrôler le dépôt et la migration car il se déplace dans le gel commme un fragment d'ADN de 50 pb.
Dépôt
de 15 µl de chaque échantillon dans un puits, le gel étant immergé dans le tampon TAE.



- Migration et séparation des produits de PCR (amplicons)
L'application d'une tension de 100V entraîne la migration, dans le gel, des fragments d'ADN chargés négativement (groupements phosphate) vers l'anode avec une vitesse d'autant plus élevée qu'ils sont plus petits. Trente minutes de migration électrophorétique suffisent.
La migration est matérialisée par la sortie très rapide des puits du colorant orangeG puis par celle du xylène cyanol. Les fragments d'ADN ne sont pas directement repérables dans le gel. Ils sont situés entre les bandes oranges et les bandes bleues.
- Révélation du gel
Les fragments d'ADN ne sont pas directement repérables dans le gel d'agarose. Pour obtenir un électrophorégramme, et visualiser les bandes qui leur correspondent , on utilise un colorant bleu cationique (basique) dont les charges positives sont attirées par les charges négatives des groupements phosphate de l'ADN. Le gel est d'abord coloré dans son ensemble puis décoloré par des bains successifs dans l'eau.L'agarose s'éclaicit alors que l'ADN retient le colorant
Rq/ Un groupe a soumis à l'électrophorèse un échantillon d'ADN non amplifié.