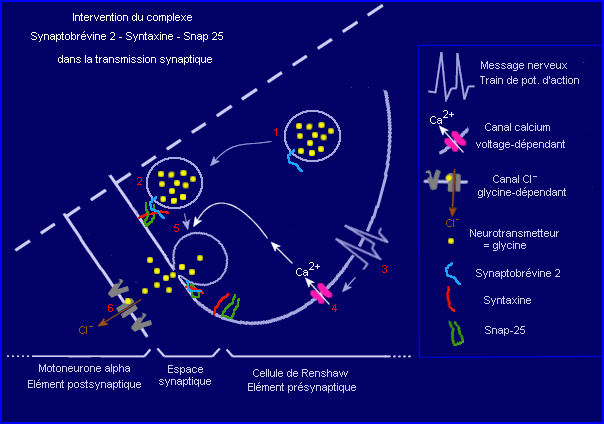
Intervention de la Synaptobrévine 2
dans la transmission synaptique
La synaptobrévine 2 est la molécule cible de la toxine tétanique. Elle a un rôle clé dans le déclenchement de l'exocytose du neurotransmetteur lors de la transmission synaptique. Un modèle du mode d'intervention de la synaptobrévine an niveau d'une synapse glycinergique inhibitrice est proposé ci-dessous afin de mieux comprendre comment la toxine tétanique peut bloquer la transmission synaptique dans le système nerveux central.
La synaptobrévine 2, une petite protéine intégrée à la membrane des vésicules synaptiques. Elle est également nommée VAMP 2 (Vesicle Associated Membrane Protein).
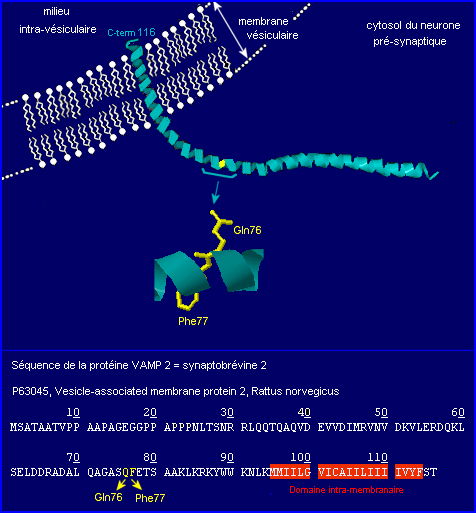
Le site d'hydrolyse spécifique reconnu par la chaîne L de la toxine tétanique (Gln76-Phe77) fait partie du domaine cytosolique.
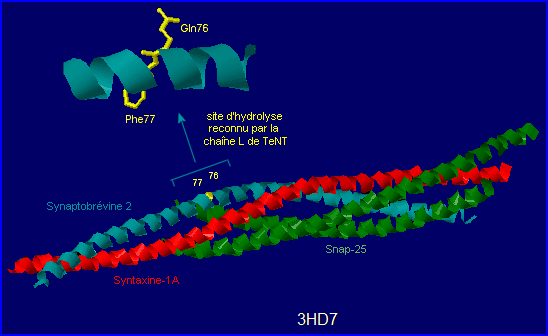
L'extension à sructure super-hélicoïdale du complexe a été cristallisée ce qui a permis à Stein A. et al d'en proposer un modèle structural (voir image à G.). Les 3 protéines sont incomplètes.
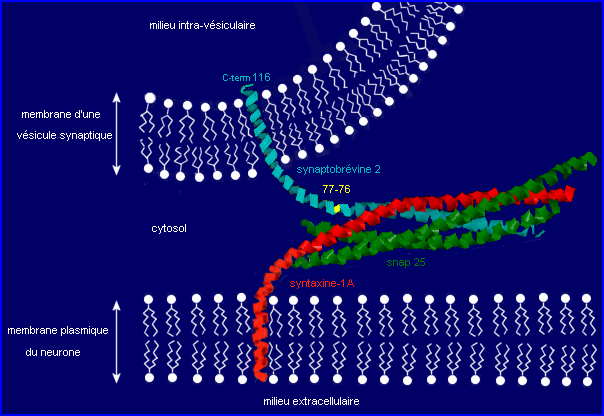
La protéine snap-25 est normalement liée à la face cytosolique de la membrane présynaptique (pas de domaine transmembranaire) mais par une partie absente du modèle.
Le modèle proposé ici concerne une synapse inhibitrice glycinergique. Il est incomplet car il ne met pas en scène tous les acteurs moléculaires impliqués.
1 : une vésicule synaptique contenant le neurotransmetteur glycine, avec la synaptobrévine intégrée à sa membrane.
2 : formation du complexe synaptobrévine- syntaxine-snap25 qui maintient la vésicule à proximité de la membrane présynaptique.
3 : arrivée d'un message nerveux présynaptique (train de potentiels d'actions).
4 : ouverture des canaux voltage-dépendants Ca2+ provoquée par les potentiels d'action, flux entrant de Ca2+.
5 : le flux entrant de Ca2+ constitue un signal transmis (protéine intermédiaire non représentée) au complexe qui change alors de conformation et met en contact la membrane vésiculaire et la membrane présynaptique ce qui induit la fusion des bicouches lipidiques et permet l'exocytose du neurotransmetteur dans la fente synaptique.
6 : des molécules de glycine sont captées par les récepteurs postsynaptiques qui changent alors de configuration et se comportent comme des canaux à Cl-. Le flux entrant d'anions provoque une hyperpolarisation de la membrane postsynaptique à l'origined'un ppsi (synapse inhibitrice).