La toxine tétanique
Structure / Fonction
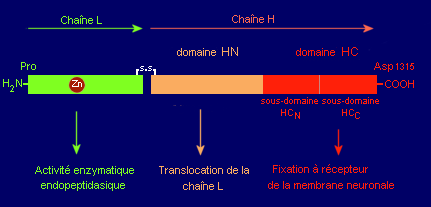
Elle est initialement synthétisée sous la forme d'une chaîne unique de 1315 résidus ac. aminés puis clivée (protéolyse) en 2 chaînes L (Light) et H (Heavy) qui restent assemblées par une liaison disulfure (entre 2 résidus Cys). C'est la protéine ainsi remaniée qui est secrétée par la bactérie sur le site de la blessure.
Structure de la toxine tétanique
(tétanospasmine)
Plusieurs fonctions assurées par la protéine
La toxicité de la toxine est due à son action au niveau de certaines synapses du système nerveux central où elle inhibe l'exocytose du neuromédiateur (Glycine ou GABA) par l'intermédiaire de son action endopeptidasique. En effet, elle clive spécifiquement la synaptobrévine 2, protéine intégrée à la membrane des vésicules synaptiques, qui intervient dans l'exocytose. Elle a donc une activité enzymatique.
Pour parvenir dans le système nerveux central, la toxine libérée à la périphérie dans la blessure doit être internalisée (endocytose) au niveau des terminaisons axoniques des motoneurones alpha. Le processus nécessite la fixation de la molécule à la membrane neuronale.
Une fois internalisée, la toxine alors intra-vésiculaire migre vers le corps cellulaire du motoneurone par transport rétrograde.
Parvenu dans le corps cellulaire du motoneurone la toxine est libérée dans l'espace d'une synapse à glycine où elle est de nouveau captée et internalisée, cette fois, par une cellule de Renshaw. Elle peut ainsi passer d'un neurone à un autre par transcytose à condition que le neurone récepteur possède un (ou plusieurs) récepteur membranaire capable de la fixer. C'est dans le cytosol du bouton synaptique de la cellule de Renshaw (ou d'un autre neurone) que la toxine exerce son activité enzymatique.
La structure de la protéine doit permettre à la toxine d'être, dans un premier temps, acheminée (interactions avec les membranes neuronales et vésiculaires) jusqu'à son site d'action puis dans un deuxième temps d'exercer son activité endopeptidasique.
Relations entre la structure de la molécule et ses fonctions
Divers types d'investigations expérimentales indiquent que les domaines de la molécule ont chacun des fonctions différentes et complémentaires, chacun intervenant dans l'une des phases essentielles de l'intoxication.
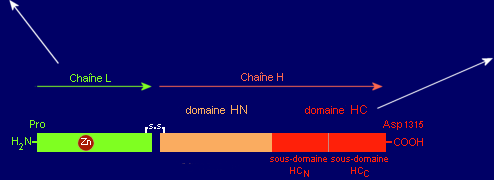
- La chaîne L : une métallo-endopeptidase qui clive la synaptobrevine 2, protéine impliquée dans l'exocytose de certains neuromédiateurs (Glycine par ex.).
- Quelques données concernant la fonction et la structure de la chaîne L
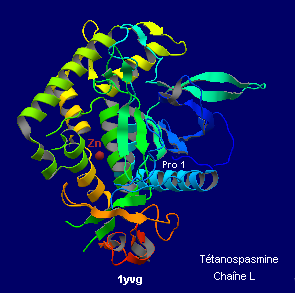
La toxine TeNT isolée à partir d'une culture de Chlostridium tetani peut être soumise à un traitement réducteur chimique ou enzymatique (système thiorédoxine-thiorédoxine réductase) qui permet la rupture du pont disulfure intercaténaire et sépare ainsi les 2 chaînes.On peut obtenir une préparation purifiée de Chaîne L utilisable pour étudier expérimentalement la fonction et la structure de cette chaîne.
Ainsi, on a pu montrer, en utilisant des modèles réduits à 2 neurones (d'invertébrés) ayant établi entre-eux des synapses bien localisées, que l'injection de molécules de la chaîne L dans l'élément présynaptique pouvait inhiber la libération du neurotransmetteur et ainsi bloquer la transmission synaptique.
La connaissance de la structure primaire de la chaîne L (455 aa) a permis d'identifier, un motif consensus des métalloprotéases (His Glu X X His associés à Zn) suggérant qu'elle devait avoir une action protéolytique, caractérisée ensuite avec l'identification de son unique substrat la synaptobrévine 2. La chaîne L clive en 2 parties cette protéine intégrée à la membrane des vésicules synaptiques, avec pour conséquence le blocage de l'exocytose du neurotransmetteur.
- Modèle moléculaire de la chaîne L
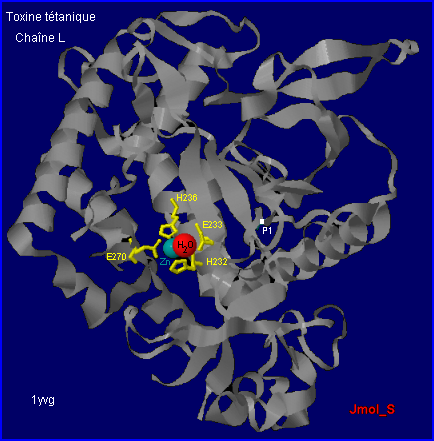
Le fichier 1yvg. pdb (février 2005) permet de reconstituer un modèle moléculaire de la chaîne L et de visualiser les résidus aa. du site actif qui coordinent Zn2+ (motif consensus des métalloprotéases) : His 232, His 236, Glu 233 ( plus ici Glu 270).
Zn2+ intervient dans le mécanisme réactionnel en participant à l'activation de la molécule d'eau impliquée dans l'hydrolyse de la liaison peptidique.
L'absence de Zn2+, le remplacement His232Val ou Glu233Gln abolissent l'activité protéolytique de la chain L.
D'autres résidus aa déterminent la spécificité protéolytique de la chaîne L vis à vis du substrat. Elle catalyse l'hydrolyse de la synaptobrévine 2 au niveau de la liaison peptidique Glu76-Phe 77 (endopeptidase).
La chaîne L est directement responsable de la toxicité de la tétanospamine.
- La chaîne H indispensable pour l'acheminement de la chaîne L sur son site d'action
La chaîne L isolée peut bloquer la libération du neurotransmetteur que si elle se retrouve dans l'élément présynaptique (injection ou synthèse in situ par traduction d'un ARNm introduit) dans lequel elle ne peut pénétrer naturellement sans l'aide de la chaîne H.
En effet, c'est la chaîne H qui assure l'acheminement de la chaîne L sur son site d'action. Elle est notamment impliquée dans la capture périphérique (fixation membranaire puis internalisation par endocytose) de la toxine par le motoneurone puis dans son transport axonique rétrograde. Elle intervient ensuite dans la trancytose entre motoneurone et cellule de Renshaw (nouvelle capture) et enfin dans le transfert de la partie active (chaîne L) du compartiment intravésiculaire vers le cytosol du neurone cible.
La chaîne H comprend un domaine HN (407 aa) et un domaine HC (451 aa) qui présente lui-même 2 sous-domaines HCN et HCc.
- Le domaine HC peut permettre la fixation de la toxine à un récepteur membranaire neuronal
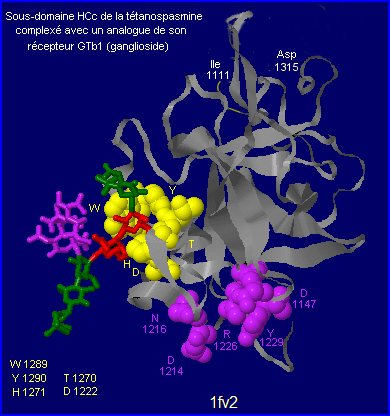
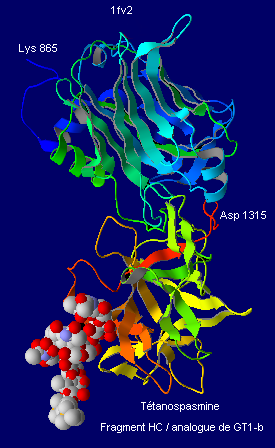
La cocristallisation du fragment HC avec un analogue du ganglioside GTb1, récepteur potentiel de la toxine intégré à la membrane neuronale a permis de construire un modèle 3D (diffraction de RX) mettant en évidence la fixation effective du fragment HC et plus précisément du sous-domaine HCc sur la partie oligosaccharidique de ce lipide complexe, en général abondant dans les membranes des neurones (Fotinou et al.).
L'analogue synthétique qui a pu être complexé à la toxine (Fotinou et al.) pour obtenir le modèle 3D (1fv2) diffère du ganglioside naturel car la céramide est remplacée par un groupement contenant de la silice (CEQ) et l'anomère a Sia6 est remplacé par la forme b Sia 6 (voir détail).
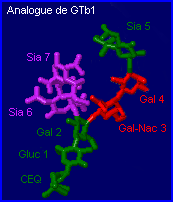
Gluc 1= glucose , Gal 2 et Gal 4 = galactose
Gal-Nac 3 = N-acéthylgalactosamine
Sia 5, Sia 6 et Sia7 = acide sialique
D'autres données suggèrent l'existence d'un deuxième site de fixation du fragment HC de la toxine à GT1b. Il forme une poche qui reconnaît la partie Sia6-Sia7 du ganglioside et implique les résidus ac. aminés N1216 (Asn), D1214 (Asp), R1226 (Arg), Y1229 (Tyr) et D1147 (Asp).
- Le domaine HN serait impliqué dans le processus qui assure la translocation de la chaîne L de l'intérieur d'une vésicule synaptique vers le cytosol du neurone cible.
Synthèse : fonction des différents domaines de la tétanospasmine